
У јесен 1910. Ернст Рутхерфорд,медитирали, покушавали да разумеју унутрашњу структуру атома. Његови експерименти на расипању алфа честица разним супстанцама убедљиво су доказали - унутар атома постоји неко масивно тело, до сада неочекивано. 1912. године, Ратерфорд би то назвао атомским језгром. У глави научника хиљаде питања је преплавило. Која је оптужба за ово непознато тело? Колико електрона је потребно да би се осигурала његова тежина?

У мају 1911. Рутхерфорд је објавио текстструктура атома, којој претходи веома значајна опомена да стабилност атомске структуре вероватно зависи од суптилности унутрашње структуре атома и кретања наелектрисаних честица, што је његова важна структурна компонента. Дакле, рођена је електронска конфигурација - нуклеарно-електронски атомски модел. Овај модел је био предодређен да игра непроцењиву улогу у нуклеарној физици.

Електронска конфигурација је редрасподела електрона преко атомских орбита. Захваљујући истраживању ума и упорности Ернста Рутхерфорда, који је успео да брани своју идеју, наука је обогаћена новим знањем чији се значај не може прецијенити.
Електронска конфигурација атома је следећа. У центру целокупне структуре је језгро састављено од различитог броја неутрона и протона за сваку супстанцу. Оно што одређује позитиван набој језгра. Око ње у одговарајућим концентричним орбитама помјерају електроне - негативно наелектрисане елементарне честице. Ове атомске орбите се такође зову шкољкама. Спољна орбита атома се зове валенца. А број електрона на њој је валенца.
Свака електронска конфигурација елеменатаразликује се по броју електрона садржаних у њему. На пример, атом најједноставније супстанце у свемиру - водоник - садржи само један јединствени електрон, атом кисеоника је осам, а електронска конфигурација гвожђа има двадесет и шест електрона.
Али детерминантна вредност у електронском моделуатом уопће нема број електрона, али шта их држи заједно и чини читав систем исправно функционалним - језгром и његовим саставом. То је језгро које даје супстанцу своје индивидуалне квалитете и карактеристике. Електрони понекад напуштају атомски модел, а онда атом добија позитивну енергију (захваљујући нуклеарном набоју). У овом случају супстанца не мења својства. Али, ако промените састав језгра, онда ће то бити сасвим другачија супстанца са различитим квалитетима. Ово није лако, али је и даље могуће.
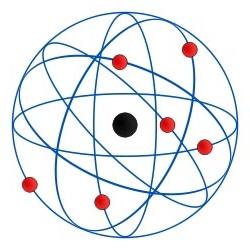
Пошто је електронска конфигурација немогућањегов главни структурни елемент - атомско језгро, требало би да посвети посебну пажњу. То је централни елемент атомског модела који обликује индивидуалне особине и карактеристике било које хемијске супстанце. Протони, који у ствари дају језгру позитивну енергију, 1840 пута су тежи од било ког електрона. Али сила пуњења протока је једнака оној од било ког електрона. У стању равнотеже, број протона у атому је једнак броју електрона. У овом случају, језгро је носилац нултог набоја.
Друга важна честица атомског језгра назива се неутрон. То је овај елемент који нема наплату која је омогућила нуклеарну реакцију ланца. Дакле, једноставно је немогуће преценити вриједност неутрона.
